世界卫生组织数据显示,全球健康领域仍面临严峻挑战,发展中国家承受了全球90%的传染病负担,很多国家需要安全可靠的医药产品,中国依然是第三大结核病高负担国家。据德勤统计,预计到2022年,全球医药及生物科研总费用将达1810亿美元,中国企业“一带一路”2016年跨境医疗并购总金额同比增长了3倍。然而,中国药企出海面临着很多风险,药企出海的路上想要走得顺利,必须要符合国际目标市场所要求的标准。医学领域的翻译对质量的要求极为严苛,任何一个细节的错误都可能导致药品研发的投入付之东流,高质量的翻译和本地化服务机构可以为出海药企保驾护航。
药企出海面临哪些严峻的问题?
随着“一带一路”倡议的积极推进,中国将影响到“一带一路”沿线国家更多人的生命健康,很多国家急需治疗艾滋病、疟疾、肝炎、登革热、霍乱、脑炎和各种癌症等疾病的救命药物。
当前“一带一路”建设即将进入另一个新阶段,根据德勤全球“一带一路”服务调查显示,中国企业出海的重点从基础建设项目扩展到医疗、科技、消费品、能源等领域,医疗跨境并购主要以慢性病、心血管和癌症用药为主。
中国企业在创新方面具有明显的优势,在研发和生产世界一流的医药产品方面有着巨大潜力,作为全球健康和发展领域的合作伙伴,为全球人群提供高质量且可负担的健康产品。
中国目前是世界第二大药品市场,中国药企出口的大多是原料药和仿制药,原料药生产能力全球第一。2017年全球原料药市场规模约1550亿美元,预计到2021年,全球原料药市场规模将上升至2250亿美元,如图所示:
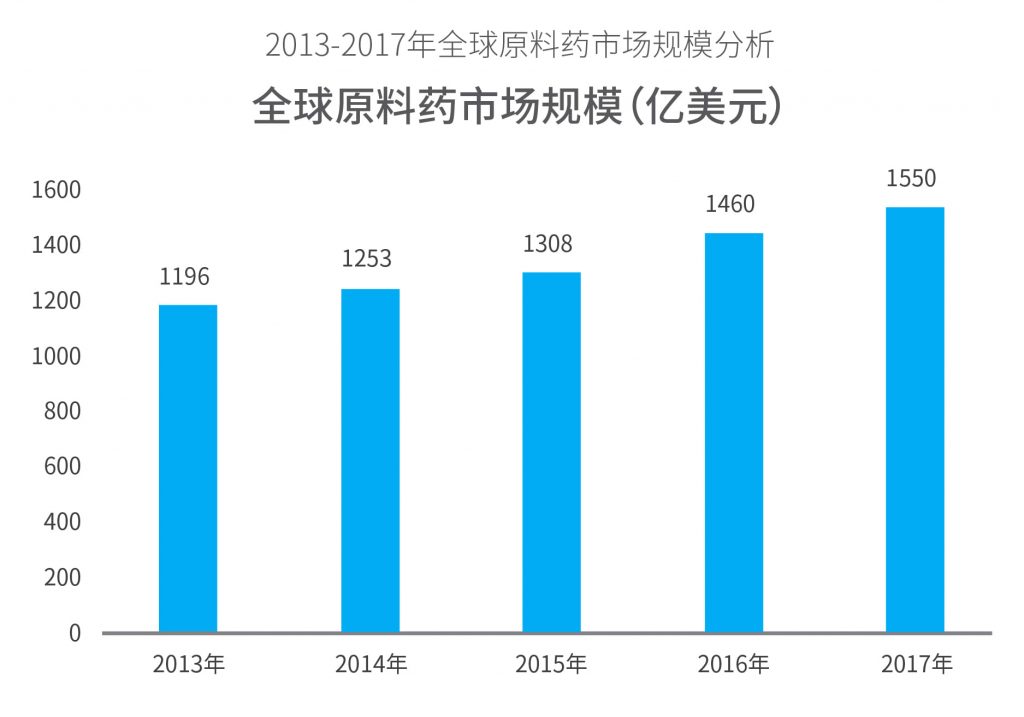
来源:华经市场研究中心、中国医药保健品进出口商会
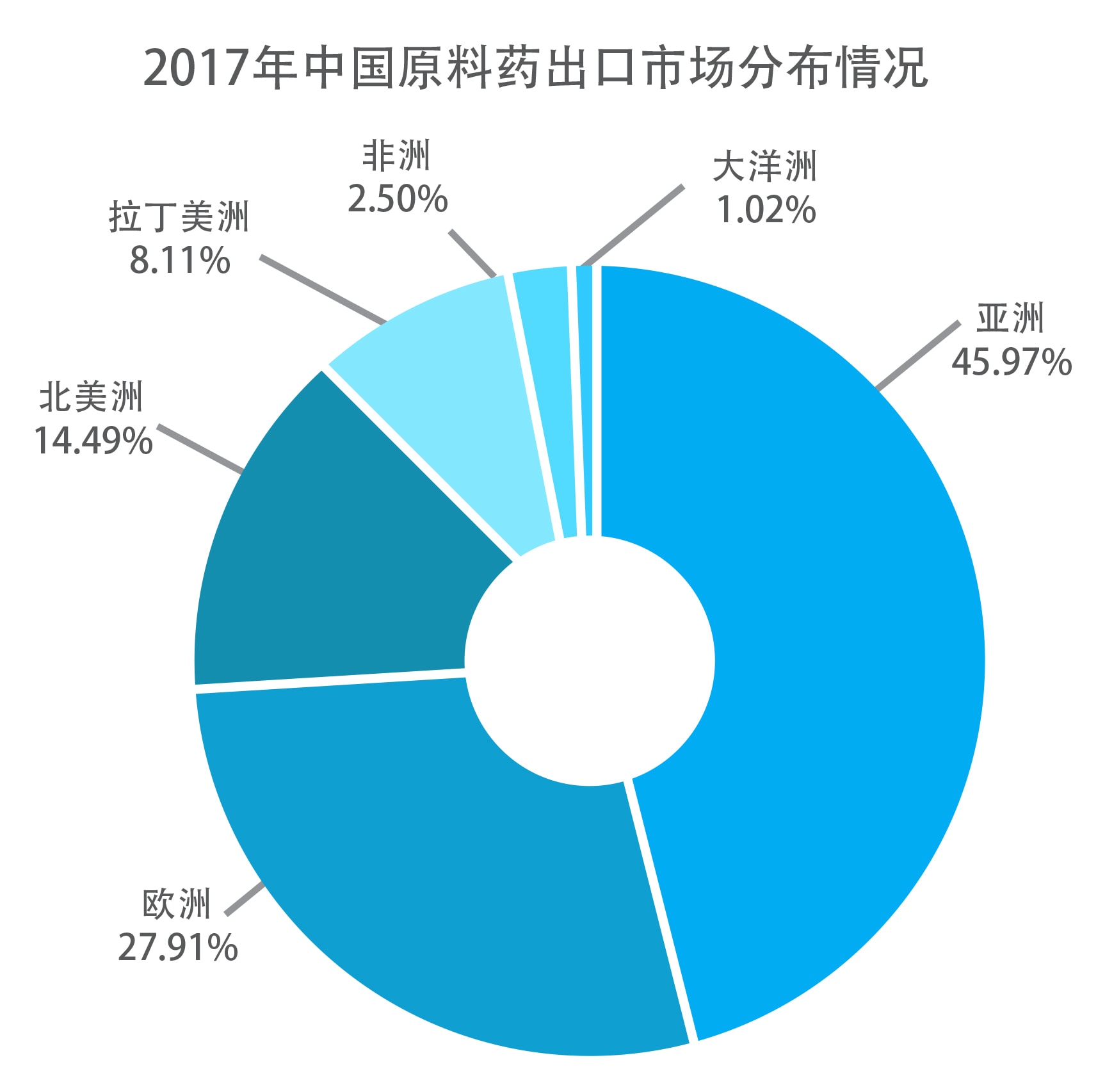
来源:华经市场研究中心、中国医药保健品进出口商会
中国是仅次于印度的美国第二大原料进口国,出口品种数量最多的依次为抗生素类、抗肿瘤药和解热镇痛类,有越来越多的中国药企在美国申报原料药,然而,中国药企出海还面临很多严峻的问题。
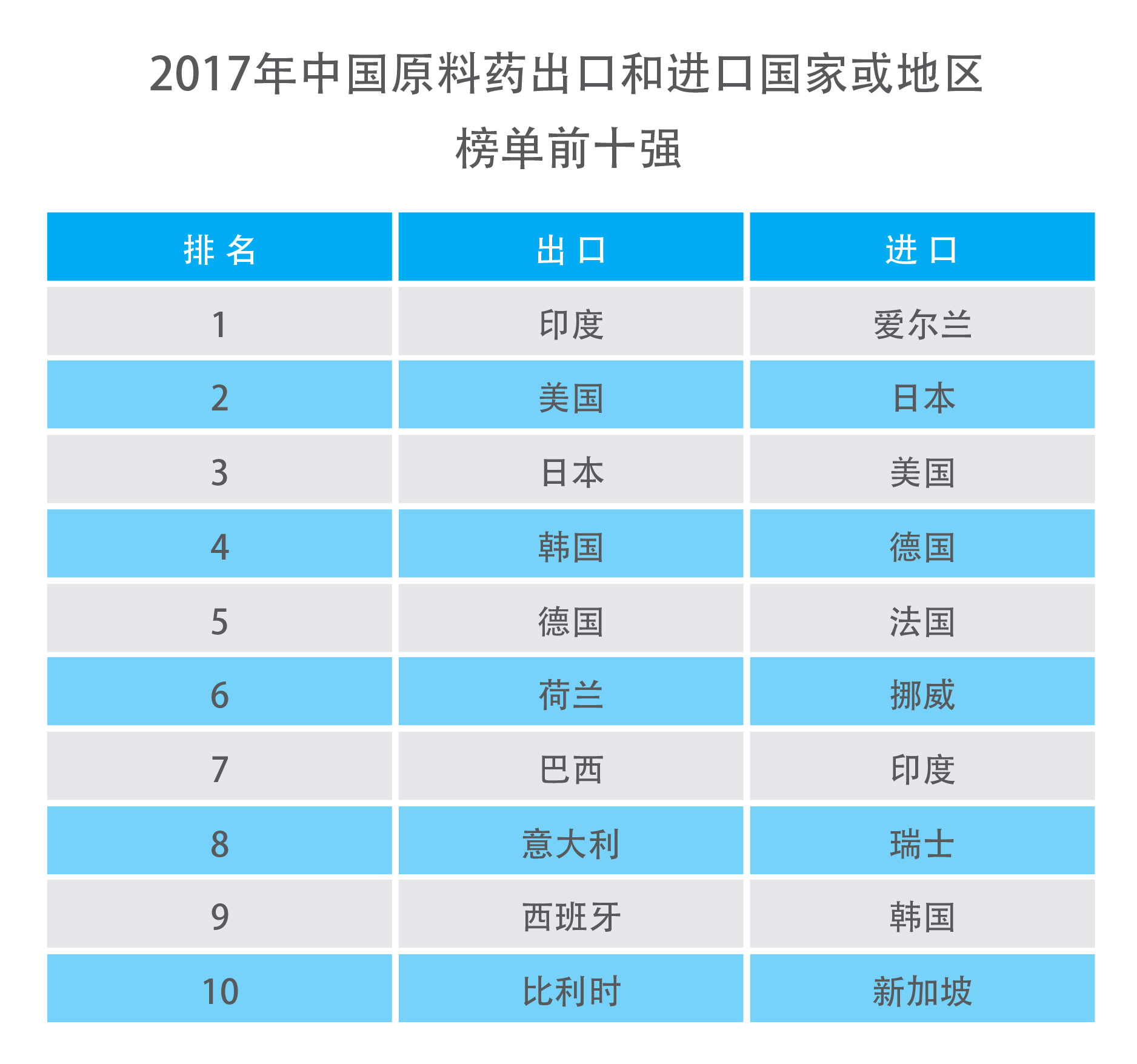
来源:中国医药保健品进出口商会
国内药企向美国出口产品时,必须面对美国食品药品管理局(FDA)的不定期检查。自2015年以来,FDA加大了对中国原料药生产商GMP(药品生产质量管理规范)的检查力度。
据媒体报道,2016年1月,浙江某药业台州工厂的原料药在FDA检查时收到警告信,被发现存在实验室数据完整性不足,部分药品不得进入美国市场。由此可见,中国药企产品在海外注册并非一帆风顺,首要面临的问题就是:质量管理体系不达标、海外注册经验少和翻译准确性要求高。
据不完全统计,2017年有10家中国药企收到FDA警告信,多因质量管理体系不达标,包括申请材料的翻译错误、关键说明材料缺失等导致的药品安全性和有效性难以证明,且药品效益大于风险。一旦收到警告信,不仅影响药品销售,甚至会导致产品被召回或查封的风险,企业的品牌和公信力将受到极大影响。
药企出海需要高质量翻译的理由
医药产品是一种特殊的商品,事关人体的健康和生命安全,药企出海的翻译材料必须符合目标市场的相关规定,地域和文化、法律制度的差异将带来一定程度的隐性风险,高质量的翻译与本地化服务可以为药企保驾护航。
一般情况下,在国外申请药品注册,各国监管部门只接受规定语种申请材料。药品翻译包括:产品技术要求、临床评价资料、患者调查问卷、临床研究操作规程和病例报告、知情同意书、患者报告结果、产品风险分析、药品特性概要、产品说明、标签及包装等。
如果药品标签和剂量指导翻译不准确,超量服用可能会对人体造成损害,不仅影响产品审核结果,还会导致产品错过最佳上市时间,造成不可弥补的损失,这就要求翻译内容必须确保专业和准确,不能出现任何错误。
除了面向审查人员的技术和说明材料,还有面向受试者和国外消费者的材料,这就需要融入当地用户的使用习惯,简明且易于理解。
在如此严格的审核标准下,与高质量的语言服务供应商合作是药企最佳的选择,专业的本地化服务机构拥有专家资源网络,翻译人员拥有生命科学领域的专业背景和翻译经验,能以最快的时间和最优的成本交付合规的翻译文本。
翻译和本地化服务是药品生命周期中的重要环节,从药品研发生产到临床试验,从政策解读到药品市场营销,每一个阶段的翻译都起着重要作用。
药企出海的哪些阶段需要翻译服务?
新药批准上市之前,要经过一系列药物临床试验以确定它的安全性和有效性。临床试验分为0期、I期、II期、III期,新药批准上市后的试验为IV期。所有新药进入临床前需向FDA提交IND(新药临床研究申请)。
新药研发一个最重要的部分是临床试验,临床试验阶段主要研究试验者使用的药方和医疗设备的疗效,一种面向多个目标国家市场的药品,在临床试验阶段要以目标国家人员为受试对象,招募国外的受试志愿者。
为了招募符合这类条件的人,临床事务部会把大量受试者招募资料翻译成各国语言,由此可见,翻译服务在临床试验的受试者招募中扮演着重要角色,这也是保证临床试验顺利进行的重要纽带。
临床试验III期成功完成后,药物申请者可提交申请NDA(新药生产上市申请)。NDA阶段包括与药物相关的所有信息:生产过程及设备、质量控制与确认、产品信息、适应症、说明书等等。
由于药品的特殊性,药品研发、临床试验和审核阶段需要8至10年的时间。药品试验成功并获得上市销售权之后的10年,仍会受到同类型仿制药的竞争。有效的信息传播内容才能起到市场营销的效果,与高质量的多语言服务供应商合作,能够更有效地助力制药商的产品信息顺利传递到目标市场。
结语
中国药企出海还处在探索阶段,面临着很多风险以及严格的法规要求,选择高质量的语言服务提供商可以解决很多问题,让药企把更多精力投入到药品研发中去。专业译员拥有生命科学领域的专业背景和翻译经验,运用数字化平台帮助药企管理翻译流程,最终确保您的产品成功并顺利地到达使用者手中。
CSOFT Health Sciences生命科学业务
CSOFT Health Sciences是华也国际旗下生命科学业务品牌,拥有ISO 9001:2015和ISO 13485:2016质量管理体系认证的首批语言服务供应商之一。CSOFT Health Sciences生命科学业务团队为全球制药和医疗设备公司提供专业翻译服务,内容包括使用说明书、临床研究报告、患者知情同意书、市场营销材料、培训和用户手册等各种医疗文件。如果您正在寻找合格的医疗翻译服务,请直接访问网站 lifesciences.csoftintl.com
